Hai teman-teman, di bawah ini akan disajikan Soal Essay Larutan Penyangga, Jawaban dan Pembahasan. Semoga saja ini bermanfaat banyak.
Soal No. 1) Terdapat dua larutan yakni NaOH 0,1 M sebanyak 50 mL kemudian dicampurkan dengan CH3COOH 0,2 M sebanyak 50 mL. Maka tentukanlah, pada campuran tersebut apakah termasuk larutan penyangga atau bukan!
Pembahasan:
Diketahui:
VNaOH=50mL;MNaOH=0,1M
VCH3COOH=50mL;MCH3COOH=0,2M
Ditanya: hasil campuran…?
Jawaban:
n NaOH = V x M = 50 mL x 0,1 M = 5 mmol
n CH3COOH = V x M = 50 mL x 0,2 M = 10 mmol
CH3COOH + NaOH→CH3COONa +H²O
Awal: 10 5 – –
Reaksi: 5 5 5 5
Sisa: 5 – 5 5
Dari hasil penilaian, terdapat sisa CH3COOH sebesar 5 mmol, maka larutan tersebuti alah termasuk larutan penyangga.
Soal No. 2) Dicampurkan dua larutan yaitu 50 mL NaOH 0,2 M dan 50 mL CH3COOH 0,1 M. tetukan apakah campuran tersebut membentuk larutan penyangga atau tidak!
Jawaban:
Tentukan jumlah mol masing-masing dengan mengalikan volume dan molaritasnya;
50 mL NaOH 01 M
Jumlah Mol = 50 ml x 0,1 M = 5 mmol
50 mL NaOH 0,1 M
Jumlah Mol = 50 ml x 0,2 M= 10 mmol
Setelah tahu molnya, cek reaskinya apakah ada sisa asam lemahnya atau sisa CH3COOH

Terdapat sisa CH3COOH sebanyak 5 mmol, berarti campuran tersebut membentuk suatu larutan penyangga.
Soal No. 3) Larutan 0,1 mol CH3COOh dicampur dengan larutan CH3COONa sehingga pH nya menjadi 5. Jika diketahui Ka. CH3COOH = 10-5, maka berapa gram CH3COONa yang dilarutkan adalah…
Pembahasan:
Dik
pH = 5
[H+] = 10-5
Jawaban:
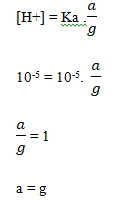
mol CH3COONa = 0,1 mol
gram = mol . MrCH3COONa
= 0,1 x 82
= 8,2 gram
Soal No. 4) Terdapat beberapa larutan berikut:
- 25 mL NaOH 0,1 M;
- 25 mL HCN 0,2 M;
- 25 mL CH3COOH 0,1 M;
- 25 mL NH4OH 0,2 M; dan
- 25 mL HCl 0,2 M.
Pasangan senyawa yang dapat membentuk larutan penyangga ialah…
Jawaban:
Hal yang paling penting jika terdapat soal semacam ini, kita perhatikan jumlah molnya. Sekarang coba kita lihat jumlah mol keseluruhan senyawa di atas.
- n NaOH = V x M = 25 mL x 0,1 M = 2,5 mmol
- n HCN = V x M = 25 mL x 0,2 M = 5 mmol
- n CH3COOH = V x M = 25 mL x 0,1 M = 2,5 mmol
- n NH4OH = V x M = 25 mL x 0,2 M = 5 mmol
- n HCl = V x M = 25 mL x 0,2 M = 5 mmol
Hal yang perlu di Ingat ,bahwa larutan penyangga merupakan bentuk dari hasil reaksi asam kuat + basa lemah dan basa kuat + asam lemah yang diakhir reaksi tersisa basa lemah atau asam lemah.
Kita lihat pasangan nomor 1 dan 2
NaOH +HCN→NaCN+H²O
Awal: 2,5 5 – –
Reaksi: 2,5 2,5 2,5 2,5
Baca Juga : Model Atom Dalton
Sisa: – 2,5 2,5 2,5
Dari reaksi dapat kita lihat terdapat sisi asam lemah sebesar 2,5 mmol. Jadi pasangan 1 dan 2 termasuk larutan penyangga.
Soal No. 5) Berapa volume larutan NaOh 0, 1M dan CH3COOH yang harus ditambahkan untuk membentuk 100 mL larutan penyangga dengan pH:6 (Ka CH3COOH= 1x 10-5)
Pembahasan:
Diketahui
M NaOH = 0,1 M
M CH3COOH = 0,1 M
Ka CH3COOH = 1×10-5
Jawaban:
n NaOH = 0,1 M x (100-V) mL = 10 – 0,1 V mmol
n CH3COOH = 0,1 M x V mL = 0,1 V mmol
CH3COOH + NaOH → CH3COONa + H2O
Awal 0,1 V 10 – 0,1 V –
Reaksi 10 – 0,1 V 10 – 0,1 V 10 – 0,1 V
Sisa 0,2 V – 10 – 10 – 0,1 V
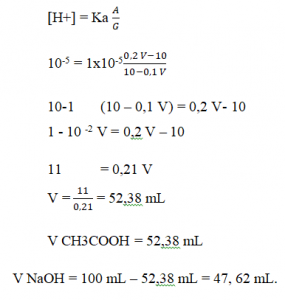
Soal No. 6) Perhatikan tebel percobaa berikut!
Maka kesimpulan dari data diatas, tentukan larutan manakah yang termasuk larutan penyangga?
Jawaban:
perhatikan Larutan penyangga apabila ditambah basa dan asam atau sedikit air,maka pH nya relatif tidak berubah. Jika berubah, perubahannya pun sangat kecil. Maka yang merupakan larutan penyangga ialah larutan Q dan S.