Hai teman-teman, berikut ini akan disajikan Contoh Soal Pembahasan Redok dan Elektrokimia. Mudah-mudahan saja Contoh Soal Pembahasan Redok dan Elektrokimia ini bermanfaat banyak.
Soal No. 1) Nilai bilangan okidasi dari Cr didalam K2CrO4 adalah . . .
a. 4
b. 5
c. 6
d. 7
e. 8
Jawaban : C
Pembahasan :

Soal No. 2) Nilai bilangan okidasi dari S didalam Na2SO3 adalah . . .
a. 4
b. 5
c. 6
d. 7
e. 8
Jawaban : A
Pembahasan:
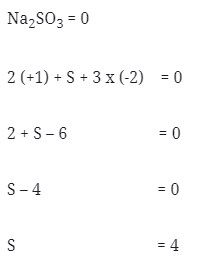
Soal No. 3) Nilai bilangan oksidasi dari Cl2 didalam Ca(ClO2)2 adalah . . .
a. 16
b. 6
c. 1
d. 4
e. 12
Jawaban : B
Pembahasan:
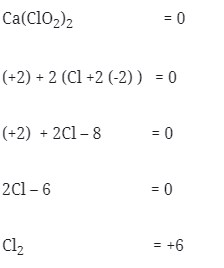
Soal No. 4) Diketahui beberapa persamaan reaksi berikut:
- C2O42− → 2CO2 + 2e;
- Al3+ + 3e → Al;
- Pb2+ + 2e → Pb; dan
- Ca → Ca2+ + 2e.
Persamaan reaksi reduksi ditunjukkan pada nomor ….
A. (1) dan (3)
B. (1) dan (4)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)
Jawaban: C
Pembahasan:
Persamaan reaksi di atas adalah setengah reaksi. Untuk menentukan jenis reaksi reduksi atau oksidasi pada setengah reaksi, cukup dengan memperhatikan letak elektron.
- Jika letak elektron di ruas kiri maka jenis reaksinya adalah reduksi (penangkapan elektron).
- Jika letak elektron di ruas kanan maka jenis reaksinya adalah oksidasi (pelepasan elektron).
Soal No. 5) Reaksi klorin dengan basa membentuk klorida dan hipoklorit menurut reaksi:
Cl2 (g) + 2NaOH (aq) → NaCl (aq) + NaClO (aq) + H2O (l)
Zat yang mengalami reaksi autoredoks beserta perubahan bilangan oksidasinya adalah ….
A. Cl2, dari −1 menjadi +1 dan 0
B. Cl2, dari +1 menjadi −1 dan 0
C. NaOH, dari 0 menjadi −1 dan +1
D. NaOH, dari −1 menjadi +1 dan 0
E. Cl2, dari 0 menjadi −1 dan +1
Jawaban: E
Pembahasan:
Reaksi autoredoks atau disproporsionasi adalah reaksi redoks di mana satu zat mengalami reduksi sekaligus oksidasi.
Mari kita tentukan perubahan bilangan oksidasi pada soal di atas! Kita tentukan bilangan oksidasi atom selain atom H dan O (karena biloks H sudah pasti +1 dan biloks O sudah pasti −2). Berarti tinggal atom Cl dan Na.
Sementara itu, Na adalah atom logam golongan IA di mana bilangan oksidasinya sudah pasti +1. Sehingga kita cukup menentukan perubahan biloks Cl saja.
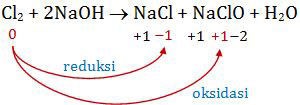
Berdasarkan perubahan biloks di atas, tampak bahwa Cl2 mengalami reaksi reduksi sekaligus reaksi oksidasi. Berarti Cl2 mengalami reaksi autoredoks.
Jadi, zat mengalami reaksi autoredoks adalah Cl2 dengan perubahan bilangan oksidasi dari 0 menjadi −1 dan +1